
導語:2019年,題為“Spatial coming of age”的文章發表于Nature reviews ,正式拉開了空間轉錄組學測序的時代序幕。2021年1月,Nature Methods又將空間轉錄組學測序評為2020年度技術。近日,哈佛大學Wyss仿生工程研究所的團隊又開發出一項名為“Light-Seq”的技術,能夠克服過去空間轉錄組學方法的諸多限制。
在多細胞生物中,不同類型的細胞在組織內會以特殊的模式組織起來。在顯微鏡下觀察,這些形形色色的細胞可能因為占據了獨特的位置、表現為不尋常的形狀或表達特定的生物標志物分子而千姿百態。當然,這些細胞之間還存在著更深層意義的差別,即基因表達的差別。研究人員通過轉錄組測序,即對細胞內存在的多種RNA分子進行測序,來更深入地了解細胞的類型和基因表達模式。
基因表達具有時間特異性和空間特異性,即不同的組織或細胞在特定發育階段或功能狀態下,基因表達會存在變化,比如胚胎發育過程中生物分子水平存在飛快的動態變化,同時細胞之間的空間關系導致了子細胞之間對稱性的破壞、決定了細胞未來的命運。通過在不同時間點使用單細胞轉錄組測序技術進行采樣,能夠了解某一細胞或組織基因表達的時間特異性。而空間特異性信息則相對較難獲得,原因是常規轉錄組測序和單細胞轉錄組測序在還原細胞所處的原始位置信息上存在困難,而傳統的原位雜交技術(In Situ ,ISH)又很難實現高通量檢測,一次最多只能分析少數幾個基因。為此,空間轉錄組學技術應運而生。
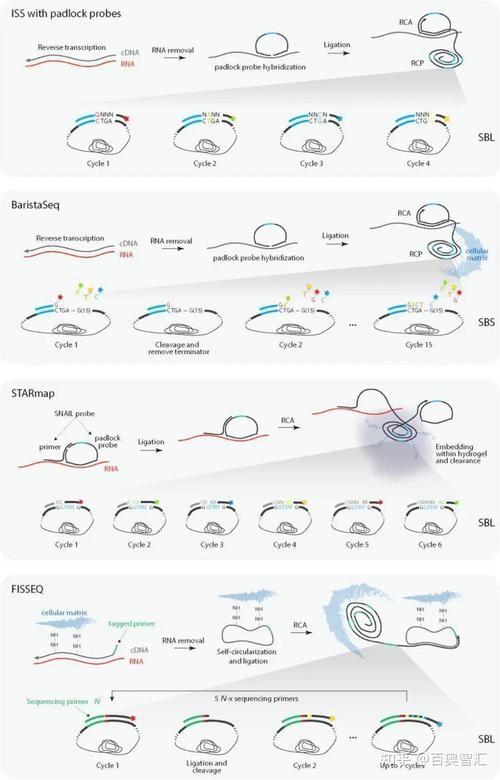
2021年8月11日,美國的研究團隊在Nature發表回顧常見空間轉錄組學技術的綜述文章“ tissue using spatial ”[1],將空間轉錄組學技術分為兩大類:(1)基于新一代測序(Next- ,NGS)的方法,即在NGS前將位置信息編碼到轉錄本上;(2)基于成像的方法,該方法又分為基于原位測序(In Situ ,ISS)的方法——直接在組織中對轉錄本進行擴增和測序,以及基于ISH的方法——成像探針在組織中被依次雜交(圖1)。這些方法雖然不同,但最終都可以看作是構建了一個基因表達矩陣,該矩陣對每個點(一個像素、一個細胞或一組細胞)的轉錄組進行捕獲。
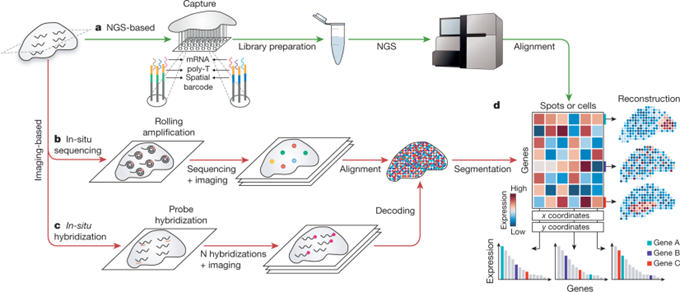
圖1 空間轉錄組學技術構建基因表達矩陣(圖源:[1])
不過,現有的空間轉錄組學技術依然存在一些限制,比如:僅能捕獲細胞總RNA分子的一小部分;達不到單細胞測序方法所能提供的分析深度和質量;破壞了原始細胞組織的環境使得對樣本進行后續分析變得不可能;以及需要專門的儀器或試劑導致成本高昂。這些缺陷阻礙了對不連續的細胞群或罕見且難以分離的細胞(比如某些特殊的腦細胞,或侵入腫瘤的免疫細胞)的研究。
為此,哈佛大學Wyss仿生工程研究所的團隊開發了一項名為“Light-Seq”的DNA納米驅動技術。研究成果以“Light-Seq: light- in situ of in fixed cells and tissues for indexed ”為題于2022年10月10日發表于Nature Methods(圖2)[2]。

圖2 研究成果(圖源:[2])
該技術允許研究人員通過光交聯過程選擇特定的目標細胞,然后利用DNA標簽(barcode)對目標細胞全部的RNA序列進行“地理標記”,隨后在DNA驅動技術的幫助下,翻譯成DNA單鏈以進行NGS測序。對于同一樣本中的不同細胞群體,可以使用不同的DNA標簽重復Light-Seq過程,以便后續分析(圖3)。

圖3 Light-Seq的概覽(圖源:[2])
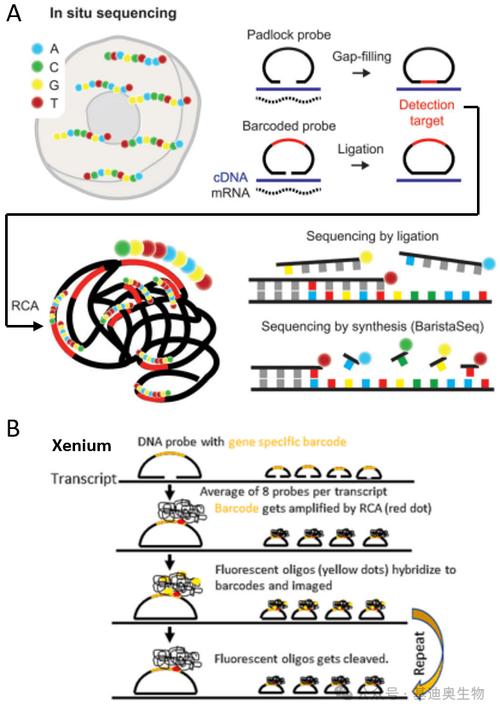
Light-Seq項目由Jocelyn(Josie)Kishi博士、Sinem Saka博士和Ninning Liu博士以及Emma West博士牽頭。2019年,Kish、Saka和West共同開發了一種名為SABER-FISH的空間轉錄組學方法,該方法用于直接在完整組織中對基因表達進行成像,能夠在固定的細胞和組織中將RNA和DNA FISH信號放大5到450倍。盡管如此,“距離捕捉細胞完整的基因表達程序還有好幾個數量級的差距。每個細胞有數千個不同的RNA分子,RNA分子過于密集,無法用目前的成像技術完整捕獲。”Kishi說,“而Light-Seq借助更高分辨率的DNA標簽和NGS全轉錄組測序,兩全其美地解決了這個問題。”
首先,DNA引物與細胞中的RNA分子進行堿基配對,以RNA為模板擴建出RNA的副本,即互補DNA( DNA,cDNA)。然后,通過紫外光的照射,將含有超快光交聯劑的標簽DNA通過光交聯反應“粘到”目標區域的cDNA上,而未被紫外光照射的區域,標簽DNA會在之后的步驟中被洗脫,這樣就對感興趣的區域打上了標記。若是使用不同的標簽配合照射不同區域的紫外光重復該過程,則能標記更多的區域。
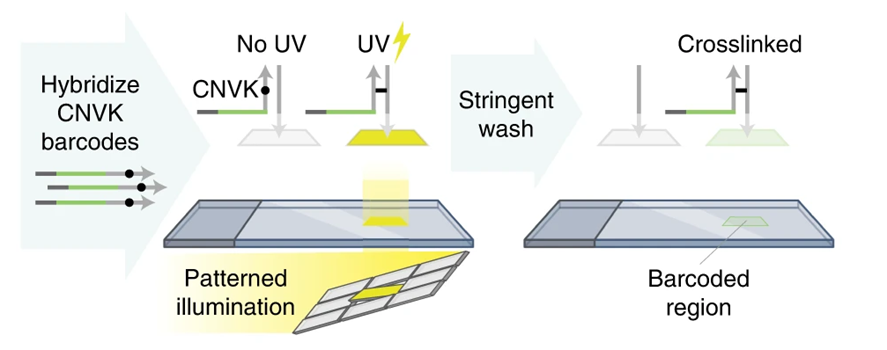
圖4 DNA光刻進行空間尋址標記(圖源:[2])
接下來,為了使NGS能夠讀取到“貼好標簽“的目標cDNA序列,使用特定的酶水解了RNA-cDNA雜交體中的RNA,將“貼好標簽”的cDNA提取出來。隨后,利用研究人員新開發的一種基于納米驅動技術的拼接反應,將標簽DNA和目標cDNA序列一起“抄錄”到新的DNA單鏈中。這些新的DNA單鏈則可以用于后續的NGS測序(圖5)。
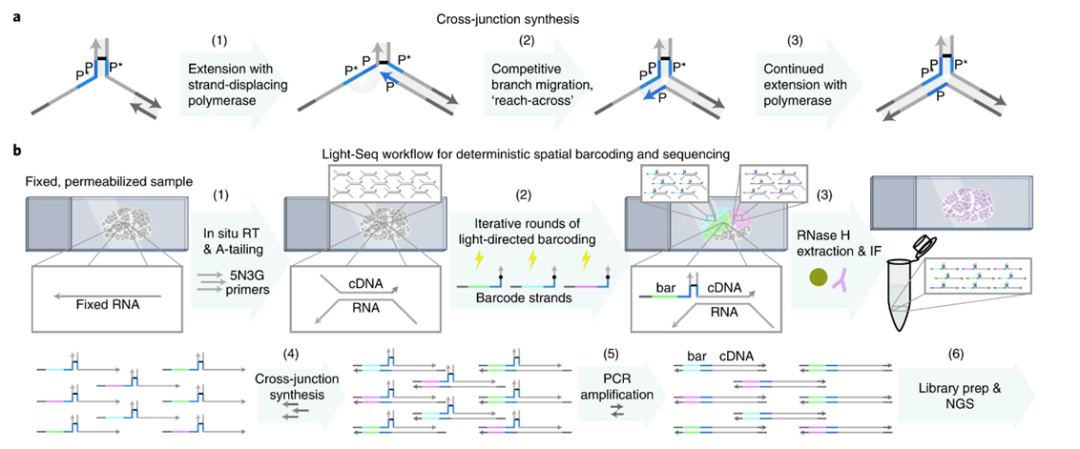
圖5 拼接反應與Light-Seq的工作流程(圖源:[2])
為了驗證該技術的細胞選擇能力和“貼標簽”的能力,研究人員將小鼠3T3細胞和穩定表達eGFP的人類HEK細胞混合進行測試。基于eGFP表達和細胞形態信息,研究人員對細胞進行了手動選擇并標記以不同的“標簽”。結果表明,小鼠和人類圖譜對于其各自的“標簽”具有良好的區分率,尤其是eGFP reads歸類到人類“標簽”的正確率高達93±0.5%。序列提取后,又對樣本進行了多重免疫熒光,驗證了樣本具備進行二次分析的完整性。
在培養細胞中首次驗證Light-Seq之后,研究人員希望將其應用于更復雜的組織,因為組織樣本中特定細胞群的RNA測序仍然充滿挑戰性,尤其是當靶細胞很少或難以分離時。為此,Kishi,Saka,Liu和West聯手,將Light-Seq應用于小鼠的視網膜切片。研究人員手動劃分了視網膜經典具備不用功能的三個細胞層。結果表明,Light-Seq達到了與單細胞測序方法相當的序列覆蓋率,并發現視網膜的三個主要層之間富集了數千個RNA(圖6)。此外,樣本保持了完整,仍能進一步對蛋白質和其他生物分子進行成像。
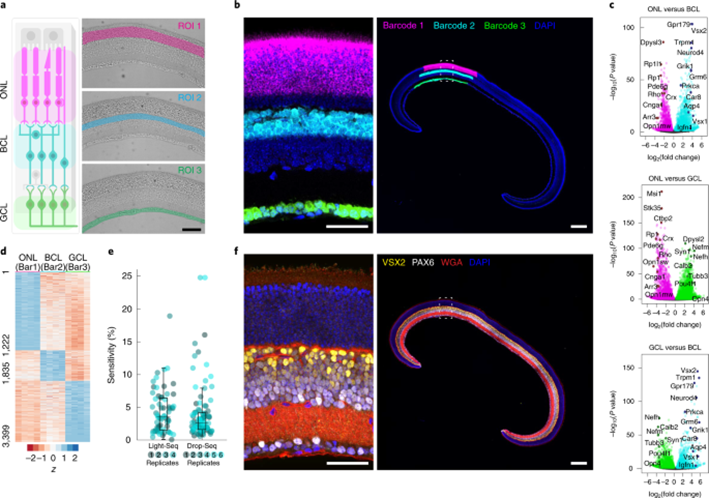
圖6 Light Seq應用于小鼠視網膜切片(圖源:[2])
將Light-Seq發揮到極致,研究人員分離出了一種非常罕見的細胞類型的完整轉錄組,這種細胞與視網膜內的其他細胞聯系極其復雜,因此難以分離。“Light-Seq還提取了該細胞中表達水平極低的特異性RNA,以及據我們所知前人從未描述過的數十種特異性生物標志物RNA,這為研究這種罕見細胞類型開辟了新的機會。”West說。
將空間轉錄組學領域向NGS敞開還帶來了有關單個RNA種類水平的信息。Kishi表示:“Light-Seq可以確定RNA結構的自然變異。”展望未來,Kishi對Light-Seq應用于更好地了解免疫系統、疾病傳播細胞以及基因和細胞治療等不同治療策略之間的相互作用充滿興趣,現在,她正積極地與合作者們一起尋求將Light-Seq商業化的道路。
撰文|風立宵
排版|喬維鈞
End
參考資料:
[1]Rao, A., Barkley, D., Fran?a, G.S. et al. tissue using spatial . Nature 596, 211–220 (2021).
[2]Kishi, J.Y., Liu, N., West, E.R. et al. Light-Seq: light- in situ of in fixed cells and tissues for indexed . Nat Methods (2022).
本文系生物探索原創,歡迎個人轉發分享。其他任何媒體、網站如需轉載,須在正文前注明來源生物探索。
往期精選
圍觀
熱文
熱文
熱文
熱文

